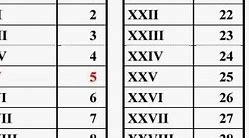
Unsur-unsur Kimia dan Nomor Atomnya
Sumber yang digunakan untuk penyusunan unsur kimia di bawah ini adalah situs Jlab Science Education. Nomor yang terletak di sebelah kiri nama unsur menandakan nomor atomnya. Adapun angka yang ada di sebelah kanan singkatan unsur adalah massa atomnya.
Nah, itulah unsur-unsur kimia dalam tabel periodik, lengkap dengan nomor dan massa atomnya. Semoga membantu, ya!
Nomor Atom Dan Nomor Massa
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
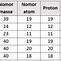
Nomor atom atau nomor proton (simbol Z) dari suatu unsur kimia adalah jumlah proton yang ditemukan dalam inti atom. Jumlahnya identik dengan jumlah muatan pada inti. Nomor atom secara unik mengidentifikasi elemen kimia. Dalam atom yang tidak bermuatan, nomor atom juga sama dengan jumlah elektron .
Jumlah dari nomor atom Z dan jumlah neutron N, memberikan nomor massa A dari sebuah atom. Karena proton dan neutron memiliki massa yang kira-kira sama (dan massa elektron diabaikan untuk banyak keperluan) dan energi ikatan nukleon selalu kecil dibandingkan dengan massa nukleon, ketika massa atom dari setiap atom dinyatakan dalam satuan massa atom terpadu (menjadi kuantitas yang disebut "massa isotop relatif"), bernilai kurang lebih 1% dari seluruh bilangan A.
MASIH ingatkah kamu dengan materi tentang unsur? Unsur merupakan zat murni yang tidak dapat diubah lagi menjadi zat lain dengan reaksi kimia, seperti emas, besi, perak, oksigen, dan masih banyak yang lain. Saat ini ada sekitar 105 unsur yang ditemukan di alam. Masing-masing unsur memiliki karakteristik yang berbeda-beda.
Atom-atom dari unsur yang berbeda memiliki jumlah partikel subatom yang berbeda. Semua atom dalam suatu unsur yang sama memiliki jumlah proton yang sama di dalam intinya. Jumlah proton ini unik untuk setiap unsur dan dijadikan sebagai dasar nomor atom.
Sementara nomor massa suatu atom ditentukan oleh jumlah neutron dan proton. Atom yang satu berbeda dengan atom yang lain karena punya jumlah elektron, proton, dan neutron yang berbeda. Berikut paparan lebih lanjut yang dilansir dari Buku Ilmu Pengetahuan Alam/Kementerian Pendidikan dan Kebudayaan Untuk SMP/MTs Kelas IX Semester 2 yang ditulis Siti Zubaidah dkk.
Baca juga : Partikel Penyusun Atom, Perkembangan Teori Atom, dan Pemanfaatannya
Jika dua atom punya massa atom berbeda, jari-jari kedua atom itu akan berbeda pula. Oleh sebab itu, atom H, O, dan C punya ukuran yang berbeda. Hubungan nomor atom, nomor massa, dan jumlah neutron dalam suatu atom yang netral (tidak bermuatan) dapat dituliskan dengan persamaan berikut.
Nomor atom = Jumlah proton (p) = jumlah elektron (e)
Nomor massa = Jumlah proton (p) + Jumlah neutron (n)
Baca juga : Hubungan Partikel dengan Atom dan Molekul dalam Benda
Setiap unsur dituliskan dengan lambang unsur. Pada penulisan lambang unsur, nomor atom ditulis sebagai subscript (turun) di kiri lambang unsur. Sedangkan nomor massa ditulis sebagai superscript (naik) di kiri atas lambang unsur, sebagaimana berikut.
X = lambang unsur. A = nomor massa. Z = nomor atom.
Sebagai contoh, penulisan lambang unsur litium (Li) yang punya nomor atom 3 dan nomor massa 7 yaitu .
Baca juga : Dampak Negatif Bioteknologi dan Rangkuman Pemanfaatannya
Sebagian besar unsur yang ada di alam sangat penting untuk kehidupan. Namun, ada beberapa unsur yang disebut logam berat, berbahaya bagi tubuh manusia dan lingkungan. Unsur ini tidak dapat didaur ulang dalam tubuh dan sulit untuk dikeluarkan, karena dalam tubuh kita tidak ada mekanisme yang berfungsi untuk menghilangkan unsur ini.
Logam berat mampu bertahan dalam tubuh sepanjang hayat kita. Konsentrasi logam berat dalam tubuh dapat bertambah sepanjang waktu atau dikenal dengan bioakumulasi.
Logam berat dapat menyebabkan berbagai penyakit, seperti kanker dan bahkan dapat menyebabkan kematian. Seorang wanita yang hamil juga dapat mengalami keguguran dan melahirkan bayi yang cacat akibat kandungan logam berat yang cukup tinggi dalam tubuhnya.
Baca juga : Aplikasi Bioteknologi Kesehatan: Antibiotik, Vaksin, Insulin Sintetis, Antibodi Monoklonal
Keterangan gambar: Beberapa contoh unsur (a) Merkuri (Hg), (b) Litium (Li), (c) Bromin (Br2), (d) Klorin (Cl2).
Pernahkah kamu mendengar musibah Minamata? Gejala Minamata pertama kali diidentifikasi pada 1956 di teluk Minamata, Jepang. Di teluk Minamata ini terdapat pelabuhan ikan, pabrik pupuk, dan senyawa kimia lain yang dalam prosesnya menggunakan merkuri (Hg).
Suatu ketika merkuri ini bocor dan masuk ke lautan sehingga mengontaminasi ikan dan hewan laut lain. Masyarakat sekitar yang mengkonsumsi ikan yang terkontaminasi merkuri mengalami bioakumulasi merkuri dalam tubuhnya. Bioakumulasi merkuri ini menyebabkan keterbelakangan mental, cacat lahir, buta dan tuli, serta menyebabkan kematian.
Kejadian musibah Minamata membuat perhatian warga dunia untuk lebih menjaga lingkungan dari pencemaran, khususnya pencemaran logam berat. Teluk Minamata akhirnya ditetapkan bebas merkuri pada Juli 1997 (41 tahun kemudian) dan warga sekitar dapat beraktivitas secara normal baik untuk menangkap ikan maupun berenang di laut.
Pernahkah kamu mendengar tentang arkeolog? Arkeolog merupakan ilmuwan yang mempelajari sejarah kehidupan dan kebudayaan zaman dahulu. Arkeolog mampu mengukur umur fosil yang telah ditemukan.
Tahukah kamu bagaimana cara mengukur umur fosil tersebut? Cara mengukur umur fosil adalah dengan mengidentifikasi atom karbon yang terkandung dalam fosil. Di alam terdapat tiga jenis atom karbon yaitu
Ketiga jenis atom C tersebut punya nomor atom sama yaitu nomor 6 tetapi nomor massa berbeda. Atom-atom yang demikian disebut isotop. Perbandingan jumlah ketiga isotop karbon di alam tetap.
Keterangan gambar: Isotop-isotop atom karbon-14.
Isotop karbon-14 atau dapat meluruh menjadi unsur lain dengan waktu paruh 5.730 tahun. Artinya kalau kamu punya isotop karbon-14 sebanyak 1,0 gram, setelah 5.730 tahun isotop itu tinggal 0,50 gram (separuh dari jumlah awal) karena meluruh menjadi unsur lain. Karbon-14 sangat reaktif sehingga mudah bergabung dengan oksigen menghasilkan gas karbon dioksida.
Jumlah karbon-14 pada tumbuhan dan hewan adalah tetap selama masih hidup. Karbon-14 pada tumbuhan dan hewan yang mati akan berkurang sebanding dengan waktu paruhnya.
Dengan menggunakan perbandingan jumlah karbon-14 yang masih tinggal pada tumbuhan atau hewan yang mati dengan jumlah karbon-12 yang ada di atmosfer, umur fosil tumbuhan atau fosil hewan tersebut dapat ditentukan. Nah, sekarang coba kamu hitung berapa umur fosil Dinosaurus yang awalnya memiliki 128 gram isotop karbon-14 dan sekarang tinggal 2 gram.
Tahukah kamu bahwa zat iodin (I) merupakan komponen hormon tiroksin yang diproduksi oleh kelenjar tiroid. Hormon tiroksin memiliki beberapa fungsi penting, antara lain meningkatkan laju metabolisme untuk menghasilkan energi, mengatur pertumbuhan dan perkembangan sistem saraf dan sistem rangka (otot dan tulang), serta menjaga tekanan darah.
Mengonsumsi iodin sebanyak 0,15 mg setiap hari sudah cukup untuk memenuhi kebutuhan kelenjar tiroid manusia untuk menghasilkan hormon tiroksin yang diperlukan tubuh. Kekurangan iodin dalam makanan mengakibatkan kelenjar tiroid membesar sampai ukuran abnormal atau yang dikenal dengan penyakit gondok.
Agar dapat mengatasi penyakit tersebut, saat ini iodin dalam bentuk kalium iodat (KIO3) atau kalium iodida (KI) banyak ditambahkan pada garam dapur atau yang biasa kita kenal dengan garam beriodium. (Z-2)
To search for Wikidata items by their title on a given site, use Special:ItemByTitle.
Sejarah Tabel Periodik Unsur Kimia
Menurut penjelasan dalam laman American Society for Biochemistry and Molecular Biology, tabel periodik telah disempurnakan oleh para ilmuwan selama hampir satu abad. Sejarahnya bermula ketika ahli kimia Prancis, Antoine Lavoisier mengelompokkan unsur-unsur kimia menjadi logam dan non logam.
Empat puluh tahun kemudian, fisikawan Jerman, Johann Wolfang Dobereiner mengamati kesamaan sifat fisik dan kimia untuk beberapa unsur. Ia kemudian mengaturnya dalam tiga kelompok yang didasarkan atas kenaikan berat atom dan menyebutnya triad.
Pada tahun 1860, pada Konferensi Kimia Internasional pertama di Karlsruhe, Jerman, diterbitkan revisi daftar unsur dan massa atomnya. Sebagai contoh, para ilmuwan menyimpulkan bahwa hidrogen akan diberi berat atom 1. Adapun berat atom lainnya akan ditentukan dengan membandingkannya dengan hidrogen.
Seorang ahli kimia asal Rusia, Dmitri Mendeleev, pada 1869 menciptakan kerangka yang di kemudian hari menjadi tabel periodik modern. Ia juga meninggalkan ruang untuk unsur-unsur yang belum ditemukan.
Tabel periodik yang serupa juga dibuat oleh ahli kimia Jerman, Lothar Meyer pada 1870. Ia juga meninggalkan ruang untuk unsur-unsur yang belum ditemukan. Bedanya, ia tidak meramalkan sifat-sifatnya sebagaimana dilakukan oleh Mendeleev.
Pada 1913, Henry Moseley, seorang fisikawan Inggris, menggunakan sinar-X untuk mengukur panjang gelombang unsur dan menghubungkan pengukuran ini dengan nomor atomnya. Ia kemudian menyusun ulang unsur-unsur dalam tabel periodik berdasar nomor atom.
Dirangkum dari detikEdu, pengelompokan unsur-unsur sistem periodik modern adalah penyempurnaan hukum periodik Mendeleev atau sering juga disebut tabel periodik bentuk panjang. Sejak saat itu, penyusunan sistem periodik modern didasarkan pada kenaikan atom dan kemiripan sifatnya.
Yuk, beri rating untuk berterima kasih pada penjawab soal!
Nomor Atom Nama Unsur Kimia Lambang Unsur Kimia Nomor Atom Nama Unsur Kimia Lambang Unsur Kimia
Nomor Atom - Nama Unsur Kimia - Simbol
Ketika sedang memperbincangkan unsur-unsur kimia, maka istilah tabel periodik unsur kimia tak akan luput dari pembahasan. Bagi detikers yang membutuhkan, di bawah ini tabel periodik unsur kimia plus nomor atomnya!
Dikutip dari situs American Chemical Society, tabel periodik mengatur semua unsur kimia yang ditemukan dalam baris dan kolom menurut kenaikan nomor atom. Biasanya, tabel ini digunakan untuk dengan cepat mendapatkan informasi tentang suatu unsur, seperti massa atom dan simbol kimianya.
Sedang butuh informasi yang ada dalam tabel periodik? Di bawah ini informasi lengkap mengenainya.